فهرست عناوین
- استات چیست ؟ مروری بر ساختار مولکولی و اهمیت آن
- پیوند کووالانسی کربن-اکسیژن در گروه کربوکسیلات و اثر رزونانس
- پیوند کربن-کربن در استات و تأثیر آن بر خواص
- ساختار رزونانسی یون استات و توزیع بار
- پیوند یونی در نمک های استات فلزی و خواص فیزیکی
- پیوند هیدروژنی در استات ها و تأثیر آن بر حلالیت و خواص فیزیکی
- بررسی پیوندهای شیمیایی در استرهای استات (مانند اتیل استات)
- تفاوت پیوندها در یون استات با استیک اسید
- تاثیر پیوندهای استات بر واکنش پذیری
- پیوندهای درون مولکولی و بین مولکولی در استات ها
- استات ها در ترکیبات فلزی کمپلکس : پیوندهای کوئوردیناسیونی
- انرژی پیوند در ساختار استات و کاربردهای آن
- تأثیر PH بر پیوندهای استات
- بررسی پیوندهای استات با طیفسنجی IR و NMR
نوشته شده توسط شرکت صنایع استات ایران
منتشر شده توسط شرکت صنایع استات ایران
تاریخ انتشار مقاله : 02-03-1404
تاریخ بروزرسانی مقاله : 02-03-1404
تعداد کلمات : 1400
آدرس مقاله : لینک مقاله
پیوندهای شیمیایی در استات ها

استات چیست ؟ مروری بر ساختار مولکولی و اهمیت آن
استات ها نمک ها یا استرهای اسید استیک هستند که از یون استات (CH₃COO⁻) به عنوان جزء اصلی تشکیل می شوند. این یون شامل یک گروه متیل (CH₃) پیوند خورده به یک گروه کربوکسیلات (COO⁻) است. ساختار این یون مسطح و دارای رزونانس است که به آن پایداری قابل توجهی می بخشد. اهمیت استات ها در شیمی آلی و بیوشیمی به دلیل نقش کلیدی آنها در متابولیسم سلولی ، سنتز ترکیبات آلی پیچیده و به ویژه در صنایع پلیمری و داروسازی غیرقابل انکار است. این یون بنیادی در بسیاری از واکنش ها و فرآیندهای شیمیایی نقش دارد و درک ساختار و پیوندهای آن برای فهم این فرآیندها ضروری است.
پیوند کووالانسی کربن-اکسیژن در گروه کربوکسیلات و اثر رزونانس
در گروه کربوکسیلات (COO⁻)کربن مرکزی با دو اتم اکسیژن پیوند کووالانسی برقرار می کند. یکی از این پیوندها پیوند دوگانه قوی C=O و دیگری پیوند یگانه C-O- است که بار منفی را حمل می کند. این ساختار به تنهایی نمی تواند پایداری گروه کربوکسیلات را به طور کامل توضیح دهد. اثر رزونانس بین دو پیوند C-O باعث توزیع یکسان بار منفی بین دو اتم اکسیژن می شود و پیوندهای C-O را به طور متوسط بین یک پیوند ساده و یک پیوند دوگانه قرار می دهد. این پایداری در واکنش پذیری استات ها و ترکیبات مرتبط با آن تأثیر بسزایی دارد.
پیوند کربن-کربن در استات و تأثیر آن بر خواص
پیوند بین گروه متیل (CH₃) و کربن گروه کربوکسیلات یک پیوند کووالانسی ساده کربن-کربن (C-C) است. در حالی که به نظر ساده می رسد ، این پیوند تأثیر قابلتوجهی بر خواص فیزیکی و شیمیایی استات ها دارد. چرخش آزاد حول این پیوند باعث انعطاف پذیری مولکول و تأثیر بر خواصی مانند نقطه ذوب ، خواص قطبی و حلالیت استات ها و واکنش پذیری می شود. علاوه بر این گروه متیل با اثر القایی خود بر توزیع بار در گروه کربوکسیلات نیز تأثیر گذاشته و واکنش پذیری آن را تعدیل می کند.
| ردیف | نوع پیوند کربن-کربن | طول پیوند تقریبی (آنگستروم) | نوع هیبریداسیون | تأثیر بر قطبیت | تأثیر بر خواص فیزیکی |
|---|---|---|---|---|---|
| 1 | پیوند یگانه (σ) ساده | 1.54 Å | sp³ – sp³ | کم | افزایش نقطه ذوب و جوش |
| 2 | پیوند دوگانه (π, σ) | 1.34 Å | sp² – sp² | متوسط | کاهش انعطافپذیری مولکول |
| 3 | پیوند بین متیل و کربونیل | 1.52 Å | sp³ – sp² | نسبتاً بالا | افزایش واکنشپذیری شیمیایی |
| 4 | زنجیره خطی C–C–C | 1.53–1.55 Å | sp³ – sp³ | پایین | افزایش پایداری ساختار |
| 5 | گروه استات جانبی (–COOCH₃) | ~1.51 Å | sp² – sp³ | متوسط به بالا | تأثیر در بوی مشخص استاتها |
| 6 | پیوند شاخهدار (ایزو) | بسته به ساختار | ترکیبی | متغیر | کاهش دمای ذوب و افزایش حلالیت |
ساختار رزونانسی یون استات و توزیع بار
ساختار واقعی یون استات (CH₃COO⁻) یک میانگین وزنی از دو ساختار کانونی معادل رزونانسی است. در هر ساختار یک اتم اکسیژن دارای پیوند دوگانه C=O و دیگری دارای پیوند یگانه C-O با بار منفی منفرد است. به دلیل رزونانس بار منفی به طور مساوی بین دو اتم اکسیژن توزیع می شود و طول پیوند C-O در هر دو سمت بین طول پیوند دوگانه و یگانه قرار می گیرد. این توزیع بار یکنواخت پایداری قابل توجهی به یون استات می بخشد و واکنش پذیری آن را تحت تاثیر قرار می دهد.
پیوند یونی در نمک های استات فلزی و خواص فیزیکی
در نمک های استات فلزی مانند سدیم استات (CH₃COONa) یا پتاسیم استات (CH₃COOK)، یون استات (CH₃COO⁻) با کاتیون فلزی Na⁺ یا K⁺ از طریق پیوند یونی قوی به هم متصل می شوند. این پیوند ناشی از نیروی جاذبه الکتروستاتیکی بین بارهای مثبت و منفی مخالف است. وجود این پیوند یونی خواص فیزیکی خاصی را به نمک های استات می دهد از جمله نقطه ذوب بالا ، حلالیت در آب (به دلیل برهم کنش یون-دیپل) و رسانایی الکتریکی در محلول آبی (به دلیل وجود یون های آزاد).
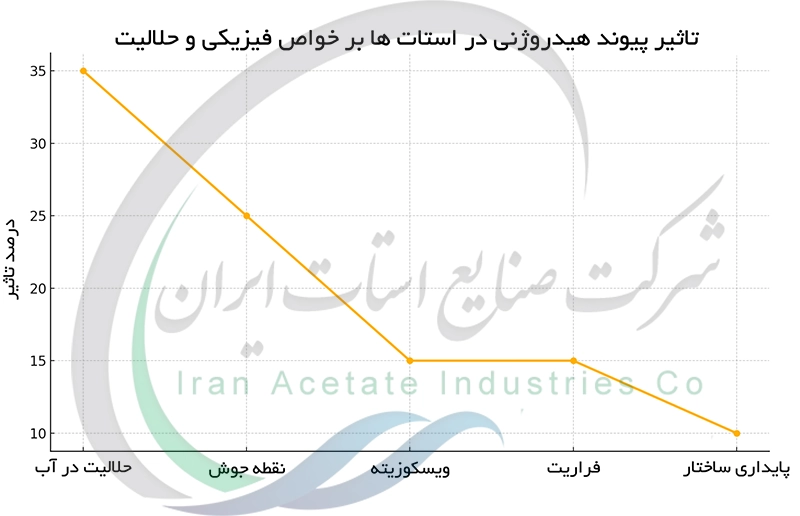
پیوند هیدروژنی در استات ها و تأثیر آن بر حلالیت و خواص فیزیکی
استات ها قادرند پیوندهای هیدروژنی با مولکول های حلال قطبی مانند آب تشکیل دهند. این پیوندها بین اتم هیدروژن قطبی مولکول آب و اتم اکسیژن دارای بار جزئی منفی گروه کربوکسیلات در یون استات ایجاد می شوند. پیوند هیدروژنی به حلالیت بالای استات ها در حلال های قطبی مانند آب کمک می کند. وجود پیوندهای هیدروژنی همچنین بر سایر خواص فیزیکی استات ها از جمله نقطه جوش ، ویسکوزیته و رفتار در محلول تأثیر می گذارد. این پیوندها سبب برهم کنش های بین مولکولی قوی تر و در نتیجه نقش مهمی در چگونگی رفتار این مواد ایفا می کنند.
بررسی پیوندهای شیمیایی در استرهای استات (مانند اتیل استات)
اتیل استات مثالی از یک استر استات است که از واکنش اسید استیک با اتانول بوجود می آید. پیوند اصلی در اتیل استات پیوند کووالانسی استری بین گروه کربونیل اسید استیک و گروه اتوکسی الکل است. این پیوند از طریق واکنش تراکمی تشکیل می شود و نسبتا پایدار است اما در شرایط اسیدی یا بازی هیدرولیز می شود که منجر به تجزیه به اسید استیک و الکل می گردد.
تفاوت پیوندها در یون استات با استیک اسید
اسید استیک (CH3COOH) یک مولکول خنثی است که دارای یک گروه کربوکسیل (-COOH) است. در این گروه پیوند کووالانسی بین کربن و اکسیژن وجود دارد. یون استات (CH3COO⁻)باز مزدوج اسید استیک یک پروتون از گروه کربوکسیل از دست داده است. این امر باعث می شود که پیوند C-O در یون استات به دلیل رزونانس طویل تر و ضعیف تر از پیوند C=O در اسید استیک باشد. اختلاف بار منفی روی اتم های اکسیژن در یون استات نیز تفاوت اساسی با اسید استیک دارد.
تاثیر پیوندهای استات بر واکنش پذیری
ساختار رزونانسی یون استات با توزیع بار منفی بین دو اتم اکسیژن واکنش پذیری آن را تعیین می کند. این توزیع بار باعث می شود که یون استات به عنوان یک هسته دوست خوب عمل کند و در واکنش های جایگزینی هسته دوستی شرکت کند. همچنین گروه متیل (CH3) در یون استات اثر القایی ایجاد می کند که بر واکنش پذیری گروه کربوکسیلات تأثیر می گذارد. توانایی یون استات در تشکیل پیوندهای هیدروژنی نیز در واکنش پذیری آن در محلول های آبی نقش مهمی دارد.
پیوندهای درون مولکولی و بین مولکولی در استات ها
استات ها چه به صورت یون و چه در ترکیباتی مانند استرهای استات پیوندهای کووالانسی قوی درون مولکولی دارند. در یون استات رزونانس بین پیوندهای C-O باعث توزیع یکنواخت بار منفی و پایداری بیشتر می شود. اما در حالت جامد یا محلول برهم کنش های بین مولکولی نیز نقش مهمی ایفا می کنند. نیروهای واندروالسی بین مولکول ها وجود دارند و در استات های حاوی هیدروژن پیوندهای هیدروژنی ضعیف تر اما تاثیرگذار بر خواص فیزیکی مانند نقطه جوش و حلالیت دیده می شود.
استات ها در ترکیبات فلزی کمپلکس : پیوندهای کوئوردیناسیونی
یون استات یک لیگاند دو دندانه ای است که می تواند از طریق اتم های اکسیژن خود با یون های فلزی پیوند کوئوردیناسیونی ایجاد کند. در کمپلکس های فلزی استات مانند استات مس(II) یا استات نیکل(II) یون استات با یون فلزی از طریق اهدای جفت الکترون های ناپیوندی اکسیژن به اوربیتال های خالی فلز پیوند برقرار می کند. این پیوندهای کوئوردیناسیونی ساختار فضایی کمپلکس و خواص آن (مانند رنگ ، مغناطیس و فعالیت کاتالیستی) را تعیین می کنند. این ترکیبات در کاتالیز همگن و واکنش های شیمیایی مختلف کاربرد دارند.
انرژی پیوند در ساختار استات و کاربردهای آن
انرژی پیوندهای مختلف در ساختار استات مانند پیوندهای C-C، C-O و C=Oبا استفاده از روش های محاسباتی کوانتومی قابل تعیین است. این داده ها در درک واکنش پذیری استات و طراحی واکنش ها ضروری هستند. به عنوان مثال انرژی پیوند C-O در گروه کربوکسیلات در تعیین مسیرهای واکنش هیدرولیز یا استریفیکاسیون و شرایط بهینه واکنش (دما ، فشار ، کاتالیزور) نقش دارد. مهندسان شیمی از این اطلاعات برای بهینه سازی فرآیندهای صنعتی و طراحی واکنش های گرماگیر یا گرماده با توجه به نیازهای انرژی استفاده می کنند.
تأثیر PH بر پیوندهای استات
PH محیط به طور مستقیم بر تعادل اسید-باز یون استات تاثیر می گذارد. در محیط اسیدی PH پایین غلظت یون هیدرونیوم بالا است و تعادل به سمت تشکیل اسید استیک (CH₃COOH) جابجا می شود. در این حالت پیوند یونی بین کاتیون فلزی و یون استات در نمک های استات تضعیف شده و پیوند کووالانسی در اسید استیک تشکیل می شود. در مقابل در محیط قلیایی PH بالا یون استات پایدارتر بوده و تمایل کمتری به پروتون گیری و تشکیل اسید استیک دارد. این تغییرات در نوع و قدرت پیوندها ، واکنش پذیری استات را در واکنش های شیمیایی تحت تأثیر قرار می دهد.
بررسی پیوندهای استات با طیفسنجی IR و NMR
طیف سنجی مادون قرمز (IR) به طور مؤثر ارتعاشات پیوندهای مختلف را شناسایی می کند. در طیف IR استات باندهای مشخصی مربوط به کشش C=O، C-O و C-H قابل مشاهده هستند. موقعیت و شدت این باندها اطلاعاتی در مورد قدرت پیوندها و اثرات رزونانس در گروه کربوکسیلات ارائه می دهند. طیف سنجی رزونانس مغناطیسی هسته ای (NMR) نیز اطلاعات ساختاری دقیقی را در اختیار می گذارد. طیف ¹H NMR جابه جایی شیمیایی پروتون های متیل و طیف ¹³C NMR جابه جایی شیمیایی اتم های کربن را نشان می دهد که نشانگر محیط شیمیایی پیرامون آنها و نوع پیوندهاست. این روش ها با هم شواهدی قطعی از ساختار رزونانسی و وجود پیوندهای هیدروژنی ارائه می دهند.




