فهرست عناوین
- مقدمه ای بر اهمیت شناخت خواص قطبی و حلالیت استات ها
- تعریف خواص قطبی در ترکیبات شیمیایی
- ساختار شیمیایی استات ها و نقش آن در قطبیت
- معرفی انواع استات های رایج و مقایسه قطبیت آن ها
- رابطه قطبیت استات ها با خواص فیزیکی مانند نقطه جوش و فشار بخار
- حلالیت استات ها در آب و حلال های قطبی
- حلالیت استات ها در حلال های غیرقطبی
- تاثیر طول زنجیره کربنی بر قطبیت و حلالیت استات ها
- نقش گروه های عاملی در تغییر حلالیت استات ها
- مقایسه میزان حلالیت استات ها با سایر ترکیبات آلی
- کاربردهای صنعتی مرتبط با حلالیت بالای استات ها
- اهمیت قطبیت استات ها در فرایندهای استخراج و جداسازی
- تاثیر دما بر میزان حلالیت استات ها
نوشته شده توسط شرکت صنایع استات ایران
منتشر شده توسط شرکت صنایع استات ایران
تاریخ انتشار مقاله : 12-02-1404
تاریخ بروزرسانی مقاله : 12-02-1404
تعداد کلمات : 1550
آدرس مقاله : لینک مقاله
خواص قطبی و حلالیت استات ها

مقدمه ای بر اهمیت شناخت خواص قطبی و حلالیت استات ها
استات ها به عنوان دسته گسترده ای از ترکیبات آلی نقش کلیدی در صنایع گوناگون ایفا می کنند. شناخت دقیق خواص قطبی و حلالیت این ترکیبات کلید موفقیت در کاربردهای مختلف آن هاست. از فرمولاسیون داروها و مواد آرایشی تا سنتز مواد شیمیایی و فرآیندهای جداسازی ، درک رفتار استات ها در محیط های مختلف از اهمیت بالایی برخوردار است. حلالیت متفاوت آن ها در حلال های قطبی و غیرقطبی محدوده وسیعی از کاربردها را ایجاد می کند. بررسی این خواص بهینه سازی فرایندهای تولید ، افزایش کارایی و کاهش هزینه ها را به دنبال خواهد داشت.
تعریف خواص قطبی در ترکیبات شیمیایی
قطبیت مولکولی ناشی از توزیع نامتقارن بار الکتریکی در ساختار مولکول است. این عدم تقارن از اختلاف الکترونگاتیوی اتم های تشکیل دهنده مولکول یا هندسه مولکولی ناشی می شود. در مولکول های قطبی بار جزئی مثبت و منفی در قسمت های مختلف مولکول تجمع می یابد و این امر موجب ایجاد گشتاور دوقطبی می شود. این گشتاور دوقطبی بر برهم کنش های بین مولکولی و در نتیجه بر خواص فیزیکی و شیمیایی مانند نقطه جوش ، حلالیت و رفتار در میدان الکتریکی تاثیر می گذارد. مولکول های قطبی تمایل به برهم کنش با سایر مولکول های قطبی دارند.
ساختار شیمیایی استات ها و نقش آن در قطبیت
استات ها دارای گروه عاملی کربوکسیلیک اسید استری (-COO-) هستند که به یک گروه آلکیل متصل است. گروه استری به دلیل وجود پیوند دوگانه کربن-اکسیژن و اختلاف الکترونگاتیوی اکسیژن و کربن قطبی است. قطبیت گروه استری عامل اصلی قطبیت در مولکول های استات است. با افزایش طول زنجیر آلکیل بخش غیرقطبی مولکول بزرگ تر شده و قطبیت کلی کاهش می یابد. استات های با زنجیره های آلکیلی کوتاه تر ، قطبیت بیشتری دارند و در حلال های قطبی مانند آب حلالیت بالاتری نشان می دهند. در مقابل استات های با زنجیره های آلکیلی بلندتر ، قطبیت کمتری داشته و در حلال های غیر قطبی بهتر حل می شوند. این ویژگی عامل تعیین کننده کاربردهای متنوع استات ها در صنایع مختلف است.
| نام استات | فرمول شیمیایی | گروه عاملی اصلی | نوع پیوندها | قطبیت کلی مولکول | دلیل قطبیت / عدمقطبیت |
|---|---|---|---|---|---|
| متیل استات | CH₃COOCH₃ | استر | کووالانسی، دو قطبی | نسبتاً قطبی | گروه کربونیل باعث ایجاد قطبیت شده است. |
| اتیل استات | CH₃COOC₂H₅ | استر | کووالانسی، دو قطبی | قطبی | اختلاف الکترونگاتیوی و ساختار نامتقارن |
| بوتیل استات | CH₃COOC₄H₉ | استر | کووالانسی | کمقطب | زنجیره بلند آلکیل اثر قطبیت را کاهش میدهد. |
| ایزو بوتیل استات | CH₃COOCH₂CH(CH₃)₂ | استر | کووالانسی | کمقطب | شاخهدار بودن زنجیره باعث پخش قطبیت میشود. |
| فنیل استات | CH₃COOC₆H₅ | استر | کووالانسی، π-π | قطبی | حلقه آروماتیک تأثیرگذار بر قطبیت است. |
| وینیل استات | CH₃COOCH=CH₂ | استر، آلکن | کووالانسی، دو قطبی | قطبی | حضور پیوند دوگانه باعث افزایش قطبیت میشود. |
معرفی انواع استات های رایج و مقایسه قطبیت آن ها
استات ها استرهای اسید استیک طیف وسیعی از ترکیبات را شامل می شوند. متیل استات (CH₃COOCH₃)، اتیل استات (CH₃COOCH₂CH₃)، بوتیل استات (CH₃COOCH₂CH₂CH₂CH₃) و ایزو بوتیل استات (CH₃COOCH₂CH(CH₃)₂) از نمونههای پرکاربرد هستند. قطبیت این استرها به طول زنجیره آلکیل وابسته است. متیل استات با کوچکترین زنجیره بیشترین قطبیت را داراست زیرا گروه استری نسبت به زنجیره آلکیل غالب تر است. با افزایش طول زنجیره (اتیل ، بوتیل ، ایزوبوتیل) بخش غیرقطبی مولکول بزرگتر شده و قطبیت کاهش می یابد. ایزو بوتیل استات به دلیل ساختار شاخه دار قطبیت کمتری نسبت به بوتیل استات خطی دارد. بنابراین متیل استات قطبی ترین و ایزو بوتیل استات کمترین قطبیت را در این گروه دارد.
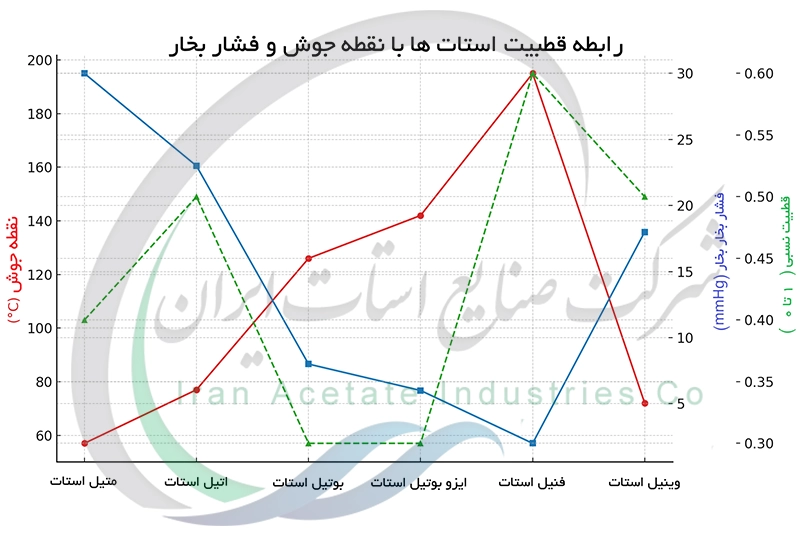
رابطه قطبیت استات ها با خواص فیزیکی مانند نقطه جوش و فشار بخار
قطبیت مولکول های استات تاثیر بسزایی بر نیروهای بین مولکولی و درنتیجه بر خواص فیزیکی آن ها دارد. نیروهای بین مولکولی قوی تر در استات های قطبی تر منجر به نقطه جوش بالاتر می شود. متیل استات به دلیل قطبیت بالاتر نقطه جوش بالاتری نسبت به بوتیل استات دارد. همچنین فشار بخار استات ها با قطبیت رابطه عکس دارد. استات های قطبی تر نیروی جاذبه بین مولکولی قوی تری دارند و بنابراین فشار بخار کمتری نشان می دهند. ویسکوزیته نیز تحت تاثیر نیروهای بین مولکولی قرار می گیرد و در استات های قطبی تر ویسکوزیته بیشتر است.
حلالیت استات ها در آب و حلال های قطبی
حلالیت استات ها در حلال های قطبی مانند آب و الکل ها به قطبیت خود استات بستگی دارد. استات های با زنجیره آلکیل کوتاه تر (مانند متیل و اتیل استات) قطبیت بالاتری داشته و تا حدودی در آب حل می شوند. این حلالیت به دلیل برهم کنش های دوقطبی-دوقطبی بین گروه استری قطبی استات و مولکول های آب است. با افزایش طول زنجیره آلکیل بخش غیرقطبی مولکول بزرگ تر شده و حلالیت در آب کاهش می یابد. در حلال های قطبی دیگر مانند الکل ها و کتون ها ، استات ها به دلیل وجود برهم کنش های دوقطبی-دوقطبی و همچنین برهم کنش های پیوند هیدروژنی (در مورد الکل ها) حلالیت خوبی دارند. ولی حلالیت در این حلال ها نیز با افزایش طول زنجیره آلکیل کاهش می یابد.
حلالیت استات ها در حلال های غیرقطبی
حلالیت استات ها در حلال های غیرقطبی مانند هگزان و تولوئن به طور قابل توجهی تحت تاثیر طول زنجیره آلکیل قرار می گیرد. در استات هایی با زنجیره های آلکیل بلندتر بخش هیدروکربنی غیرقطبی غالب بوده و برهم کنش های واندروالسی با حلال های غیرقطبی عامل اصلی انحلال است. این برهم کنش ها ضعیف تر از برهم کنش های دوقطبی-دوقطبی در حلال های قطبی هستند. بنابراین استات های با زنجیره های بلندتر حلالیت بیشتری در حلال های غیرقطبی نشان می دهند. در مقابل استات های با زنجیره های کوتاه تر به دلیل غلبه قطبیت گروه استری در حلال های غیرقطبی کم محلول هستند. در این محیط ها مولکول های استات تمایل به تجمع و تشکیل فاز جداگانه دارند.
تاثیر طول زنجیره کربنی بر قطبیت و حلالیت استات ها
افزایش طول زنجیره آلکیل در استات ها قطبیت کلی مولکول را کاهش می دهد. این به دلیل غلبه تدریجی بخش غیرقطبی هیدروکربنی بر گروه استری قطبی است. با افزایش تعداد اتم های کربن نیروهای واندروالسی بین مولکول های استات افزایش یافته و تاثیر قطبیت گروه استری کاهش می یابد. در نتیجه حلالیت در حلال های غیرقطبی افزایش یافته و حلالیت در حلال های قطبی کاهش می یابد. این الگوی تغییر حلالیت کاربردهای متنوع استات ها را در سیستم های مختلف از جمله فرمولاسیون های دارویی و رنگ ها تعیین می کند.
نقش گروه های عاملی در تغییر حلالیت استات ها
اضافه کردن یا تغییر گروه های عاملی در ساختار استات ها به طور قابل توجهی بر قطبیت و در نتیجه حلالیت آن تاثیر می گذارد. گروه های عاملی قطبی مانند هیدروکسیل (-OH) یا آمینو (-NH₂) قطبیت کلی مولکول را افزایش داده و حلالیت در حلال های قطبی را بهبود می بخشند. در مقابل گروه های عاملی غیرقطبی مانند آلکیل قطبیت را کاهش داده و حلالیت در حلال های غیرقطبی را افزایش می دهند. به عنوان مثال اضافه کردن یک گروه هیدروکسیل به یک استات با زنجیره بلند ، حلالیت آن را در آب افزایش می دهد. این ویژگی امکان طراحی استات هایی با خواص حلالیت خاص را برای کاربردهای متفاوت فراهم می کند.
مقایسه میزان حلالیت استات ها با سایر ترکیبات آلی
استات ها در مقایسه با الکل ها ، کتون ها و اترهای هم ساختار حلالیت متفاوتی در آب و حلال های آلی از خود نشان می دهند. الکل ها به دلیل گروه هیدروکسیل قطبی در آب حلالیت بالاتری دارند در حالی که حلالیت استات ها در آب به طول زنجیره آلکیل وابسته است و با افزایش طول زنجیره کاهش می یابد. کتون ها و اترها نیز بسته به اندازه و ساختار حلالیت متنوعی در آب نشان می دهند. استات ها در حلال های آلی غیرقطبی حلالیت بیشتری نسبت به الکل ها نشان می دهند زیرا بخش غیرقطبی آن ها با افزایش طول زنجیره غالب تر می شود. این تفاوت ها در حلالیت کاربردهای متفاوتی را برای این دسته از ترکیبات در صنایع مختلف ایجاد می کند.
کاربردهای صنعتی مرتبط با حلالیت بالای استات ها
حلالیت بالای برخی استات ها آن ها را به حلال های ایده آل در صنایع مختلف تبدیل کرده است. در صنعت رنگ و پوشش های سطحی استات ها به عنوان حلال های مؤثر برای رزین ها و پیگمنت ها استفاده می شوند و به پخش یکنواخت رنگ کمک می کنند. در تولید چسب ها استات ها موجب بهبود چسبندگی و افزایش سرعت خشک شدن می شوند. در صنعت چاپ و تولید جوهر برای حل کردن مواد رنگی و بهبود کیفیت چاپ به کار می روند. در صنایع داروسازی استات ها به عنوان حلال در فرمولاسیون داروها برای افزایش انحلال پذیری و بهبود زیست فراهمی داروها کاربرد دارند.
اهمیت قطبیت استات ها در فرایندهای استخراج و جداسازی
قطبیت استات ها نقش حیاتی در روش های استخراج و خالص سازی دارد. در استخراج مایع-مایع انتخاب حلال استات مناسب با توجه به قطبیت ترکیب مورد نظر راندمان استخراج را به طور چشمگیری بهبود می بخشد. استات های قطبی تر در استخراج ترکیبات قطبی مؤثرترند. در کروماتوگرافی قطبیت استات ها به عنوان فاز ثابت یا متحرک در جداسازی مخلوط های پیچیده آلی از اهمیت بالایی برخوردار است. در تصفیه مواد شیمیایی از استات ها برای خالص سازی و حذف ناخالصی ها با استفاده از اختلاف قطبیت استفاده می شود. این کاربردها نشان دهنده اهمیت بررسی دقیق خواص قطبی استات ها در طراحی فرایندهای جداسازی کارآمد است.
تاثیر دما بر میزان حلالیت استات ها
حلالیت استرها از جمله استات ها در حلال های مختلف تابعی از دماست. این وابستگی به ماهیت برهم کنش های بین مولکولی بین استات و حلال مربوط می شود. به طور کلی حلالیت استات ها در حلال های قطبی با افزایش دما افزایش می یابد. انرژی جنبشی بالاتر مولکول ها ، برهم کنش های بین مولکولی بین استات و حلال را قوی تر می کند و در نتیجه انحلال پذیری بیشتر می شود. اما در حلال های غیرقطبی این وابستگی پیچیده تر است و گاهی با افزایش دما حلالیت کاهش می یابد. این به دلیل رقابت بین برهم کنش های واندروالسی بین مولکول های استات و برهم کنش های ضعیف تر با حلال است.




