فهرست عناوین
- مقدمه
- استات ها چه هستند؟
- اهمیت تاریخی و امروزی استات ها
- شیمی پایه تشکیل استات ها
- تهیه نمک های استات در آزمایشگاه
- سنتز استرهای استات در آزمایشگاه
- نقش کاتالیزگرها در تولید استات ها
- تجهیزات و ملاحظات ایمنی در سنتز استات ها
- نمونه های مهم استات های تولید شده در آزمایشگاه
- استات سلولز و استات های پلیمری
- مسیرهای زیستی تولید استات ها
- خالص سازی و جداسازی محصولات استات
نوشته شده توسط شرکت صنایع استات ایران
منتشر شده توسط شرکت صنایع استات ایران
تاریخ انتشار مقاله : 19-05-1404
تاریخ بروزرسانی مقاله : 19-05-1404
تعداد کلمات : 2500
آدرس مقاله : لینک مقاله
تولید آزمایشگاهی استات ها

مقدمه
استات ها یک دسته بزرگ از ترکیبات شیمیایی است که یا به صورت نمک های اسید استیک هستند یا استرهای آن محسوب می شوند. به بیان ساده هر ترکیبی که حاوی یون استات (CH₃COO⁻) باشد یا دارای گروه عاملی استات (CH₃COO–R) در ساختار خود باشد ، در این طبقه قرار می گیرد. این ترکیبات در طبیعت و صنعت فراوان هستند و می توان آن ها را در هر چیزی از استات سلولز موجود در فیلم ها و الیاف گرفته تا اتیل استات که به عنوان حلال در لاک پاک کن ها استفاده می شود ، مشاهده کرد. تولید آزمایشگاهی استات ها یکی از تمرین های اساسی در شیمی است و به دانشمندان امکان می دهد این مواد پرکاربرد را در شرایط کنترل شده ایجاد و بررسی کنند.
استات ها چه هستند؟
اصطلاح استات در شیمی به ترکیباتی گفته می شود که از اسید استیک مشتق شده اند. از دیدگاه شیمیایی ، استات می تواند یک نمک باشد که یون استات (CH₃COO⁻) در خود دارد یا یک استر که از ترکیب اسید استیک با یک الکل تشکیل شده است. وجه مشترک همه آن ها حضور گروه استات است که دارای دو اتم کربن (یکی بخشی از یک گروه کربونیل) و فرمول کلی C₂H₃O₂ می باشد. به بیان ساده هرگاه اسید استیک واکنش دهد و هیدروژن اسیدی خود را از دست بدهد ، یک ترکیب استات تشکیل می شود. در مقیاس بزرگ ، تولید صنعتی استات ها با استفاده از روش های شیمیایی کنترل شده انجام می شود تا این ترکیبات پرکاربرد در مقادیر زیاد برای مصارف مختلف صنعتی و آزمایشگاهی فراهم گردند..
اهمیت تاریخی و امروزی استات ها
ترکیبات استات در طول تاریخ نقش های مهمی داشته اند. در دنیای باستان استات سرب (II) به عنوان شیرین کننده (با وجود سمی بودن آن) استفاده می شد و به شکر سرب معروف بود. در قرون میانه و رنسانس ، کیمیاگران با ترکیب سرکه (اسید استیک) با سنگ آهک موفق به تولید استات کلسیم شدند ؛ این استات کلسیم بعدها با حرارت دادن تجزیه و استون تولید شد که یکی از روش های اولیه تهیه آن حلال محسوب می شود. استات مس (زنگار) نیز از دیگر استات های قدیمی بود که به عنوان رنگدانه و در آزمایش های شیمیایی اولیه به کار می رفت. در زمان مدرن استات ها همچنان از اهمیت زیادی در علم و صنعت برخوردارند. در اوایل قرن بیستم استات سلولز به عنوان جایگزینی با قابلیت اشتعال کمتر برای نیترات سلولز در فیلم های عکاسی و الیاف توسعه یافت و تحول بزرگی در عکاسی و نساجی ایجاد کرد. امروز مقادیر عظیمی از وینیل استات به صورت صنعتی تولید می شوند که پیش ماده پلی وینیل استات (PVAc) و پلی وینیل الکل است و در تولید رنگ ها ، چسب ها (چسب سفید معمولی) و پوشش ها به کار می رود. علاوه بر این نمک های متعدد استات مانند استات سدیم و استات کلسیم برای کاربردهایی از افزودنی های غذایی گرفته تا معرف های آزمایشگاهی تولید می شوند. حتی در حوزه بازار و بازرگانی خرید ایزو بوتیل استات مشهد نیز بیانگر نقش گسترده این ترکیبات در صنعت و تجارت امروز است. اهمیت مداوم استات ها در کاربردهای متنوع آن ها و بهبود مستمر روش های تولیدشان مشهود است.
شیمی پایه تشکیل استات ها
تشکیل استات ها بر پایه واکنش های شیمیایی اسید استیک است و به سه مسیر اصلی انجام میشود : خنثی سازی که در آن اسید استیک با بازهایی مانند هیدروکسیدها یا کربنات ها واکنش داده و نمک استات و آب یا دی اکسید کربن تولید می کند ؛ استری سازی که طی آن اسید استیک با الکل ها در حضور کاتالیزور اسیدی واکنش داده و استرهایی مانند اتیل استات حاصل می شود و استیله کردن که با استفاده از انیدرید استیک یا استیل کلرید ، گروه استیل به ترکیبات دارای گروه هیدروکسیل افزوده شده و محصولات پیچیده تری مانند استات سلولز یا آسپرین تولید می گردد. این واکنش ها اساس تولید گستره ای از استات های آلی و معدنی در صنایع شیمیایی ، دارویی و پلیمر را تشکیل می دهند.
تهیه نمک های استات در آزمایشگاه
در محیط آزمایشگاه تهیه نمک های استات معمولا شامل یک واکنش خنثی سازی ساده است. شیمی دان کار را با اسید استیک (که اغلب به صورت اسید استیک گلاسیال یا سرکه استفاده می شود) آغاز کرده و یک باز یا ترکیب فلزی مناسب را به آن می افزاید. مواد رایج شامل هیدروکسیدهای فلزی مانند NaOH، کربنات های فلزی مثل Na₂CO₃ یا CaCO₃ یا بی کربنات ها مانند جوش شیرین ، NaHCO₃ هستند. باز به آرامی به اسید اضافه می شود تا واکنش انجام گیرد و استات مربوطه به همراه آب و در صورت استفاده از کربنات ها ، گاز CO₂ تشکیل شود. این فرآیند معمولاً با هم زدن و در صورت لزوم خنک سازی انجام می شود ، زیرا واکنش می تواند کمی گرمازا باشد و در صورت استفاده از کربنات ها کف ایجاد کند. پس از اتمام واکنش که با متوقف شدن حباب های گاز یا پایدار شدن pH نشان داده می شود، محلول حاصل حاوی نمک استات حل شده در آب است. برای جدا کردن استات خالص ، آب حلال از طریق تبخیر یا حرارت دهی ملایم حذف می شود. محلول را می توان تغلیظ کرد و سپس اجازه داد تا بلورها تشکیل شوند و استات جامد به دست آید. به عنوان مثال برای تهیه استات سدیم می توان اسید استیک را با سدیم بی کربنات واکنش داد تا زمانی که قطع شدن خروج گاز نشان دهنده اتمام واکنش باشد ، سپس محلول را تبخیر کرد تا بلورهای استات سدیم حاصل شود. بسیاری از نمک های استات هنگام تبلور آب تبلور در ساختار خود می گیرند (برای نمونه استات سدیم اغلب به صورت تری هیدرات متبلور می شود). محصول نهایی معمولاً با فیلتراسیون جمع آوری و خشک می شود و آماده استفاده به عنوان معرف یا در آزمایش های دیگر است.
سنتز استرهای استات در آزمایشگاه
سنتز استرهای استات در آزمایشگاه معمولاً با واکنش استری شدن فیشر انجام می شود که شامل واکنش اسید استیک با یک الکل در حضور کاتالیزگر اسید قوی مانند اسید سولفوریک است. در روش رایج مخلوط اسید و الکل تحت رفلاکس حرارت داده می شود تا واکنش به سمت تشکیل استر پیش رود و آب به عنوان محصول جانبی حذف گردد. برای افزایش بازده (طبق اصل لوشاتلیه) می توان از یکی از واکنش دهنده ها به مقدار اضافی استفاده کرد یا آب را به طور مداوم خارج نمود ، مثلاً با دستگاه دین استارک. جداسازی معمولاً با تقطیر انجام می شود چون بسیاری از استرهای استات مانند اتیل استات نقطه جوش پایین تری نسبت به اسید یا آب دارند. همچنین می توان از قیف جداکننده استفاده کرد تا استر نامحلول به صورت لایه جدا جدا شود. محصول خام معمولاً شسته و خشک شده و سپس تقطیر می شود تا خالص گردد. روش جایگزین سریع تر استفاده از انیدرید استیک یا استیل کلرید به جای اسید استیک است که بدون نیاز به کاتالیزگر و حتی در دمای اتاق ، الکل ها را به استر تبدیل می کنند ، اما به دلیل خورنده بودن نیازمند احتیاط هستند.
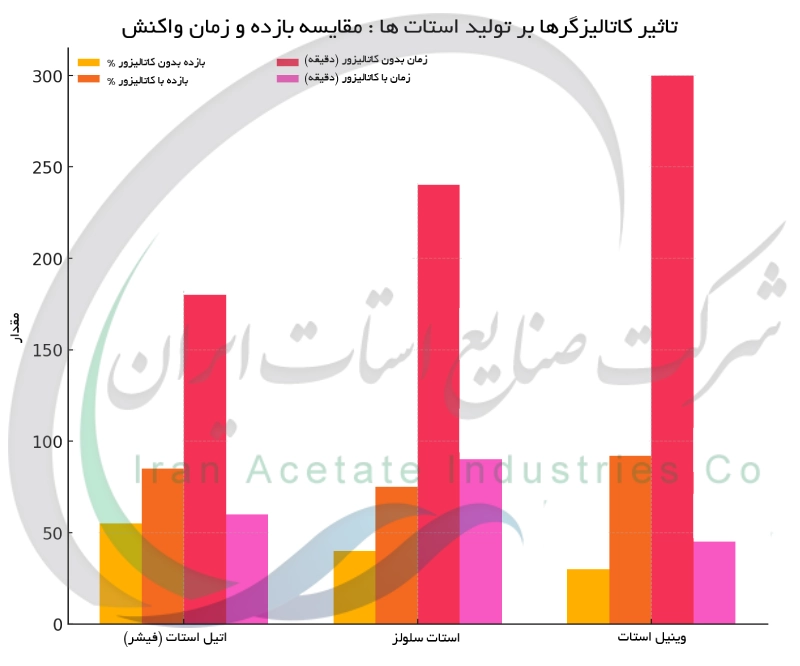
نقش کاتالیزگرها در تولید استات ها
در تولید استات ها استفاده از کاتالیزگرها نقش کلیدی در افزایش سرعت و بازده واکنش دارد. در واکنش های استری شدن ، اسیدهایی مانند اسید سولفوریک غلیظ با پروتونهکردن اسید استیک آن را الکتروفیل تر کرده و حمله الکل را تسهیل می کنند ، که این امر سرعت تشکیل استر را به طور چشمگیری افزایش می دهد. بدون کاتالیزگر واکنش بسیار کند و ناقص پیش می رود. سایر اسیدها مانند اسید کلریدریک و پاراتولوئن سولفونیک اسید نیز می توانند همین عملکرد را داشته باشند. در تولید استات سلولز ، اسید سولفوریک به استیله شدن زنجیره سلولز کمک می کند. در صنعت کاتالیزگرهای فلزی مانند پالادیم تولید وینیل استات از اتیلن و اسید استیک را امکان پذیر می سازند. همچنین کاتالیزگرهای آنزیمی مانند لیپازها در شرایط ملایم و سازگار با محیط زیست ، سنتز استرهای استات را انجام می دهند و نیاز به اسیدهای قوی را کاهش می دهند. این رویکردها باعث کوتا هشدن زمان واکنش ، افزایش بازده و بهبود کارایی فرآیند می شوند.
تجهیزات و ملاحظات ایمنی در سنتز استات ها
تجهیزات تولید استات بسته به روش متفاوت است. برای خنثی سازی ساده و تهیه نمک ، بشر یا ارلن همراه با همزن و دماسنج کافی است. در واکنش های استری شدن از بالون تهگرد با مبرد رفلاکس برای حرارت طولانی بدون تبخیر اجزای فرار استفاده می شود و خالص سازی با دستگاه تقطیر انجام می گیرد. ابزارهای دیگر شامل قیف قطره ای ، استوانه مدرج ، پیپت و وسایل فیلتراسیون هستند. ایمنی اهمیت بالایی دارد. اسید استیک غلیظ خورنده و فرار است و باید در هود با تجهیزات حفاظتی استفاده شود. واکنش های تولیدکننده گاز مانند CO₂ باید در ظروف با فضای اضافی انجام شوند. هنگام حرارت دادن استرهای اشتعال پذیر ، از گرمکن الکتریکی به جای شعله مستقیم استفاده می شود. کار با انیدرید استیک یا استیل کلرید باید آرام و با احتیاط باشد. پسماندهای اسیدی پیش از دفع خنثی و استاتهای فلزات سنگین به عنوان زباله خطرناک جمع آوری می شوند.
نمونه های مهم استات های تولید شده در آزمایشگاه
طیف گسترده ای از ترکیبات استات را می توان در آزمایشگاه سنتز کرد ؛ از نمک های ساده گرفته تا استرها و پلیمرهای پیچیده. هر استات روش تهیه ، خواص و کاربردهای مخصوص به خود را دارد. با بررسی چند نمونه شاخص از استات ها می توان به تنوع این دسته از ترکیبات پی برد. برخی از استات ها نمک های معدنی (جامدات بلوری) هستند در حالی که برخی دیگر مایعات آلی با عطر ویژه اند و حتی برخی به صورت پلیمر وجود دارند. در ادامه به نمونه های مهمی از استات های رایج که در آزمایشگاه تهیه یا مشاهده می شوند اشاره شده است تا نحوه تهیه ، شکل ظاهری و دلیل مفید بودن آن ها روشن گردد. برای مثال استات سدیم به سادگی با خنثی کردن اسید استیک توسط جوش شیرین تهیه می شود و به تشکیل بلورهای یخ داغ معروف است که در گرم کننده های دستی کاربرد دارند. از سوی دیگر استرهایی مانند استات ایزوآمیل از طریق استری شدن فیشر تهیه می شوند و به خاطر رایحه قوی میوه ای شان (روغن موز) مشهورند. همچنین استات های فلزی مانند استات مس (II) رنگ های جذابی (آبی-سبز) دارند و می توان آن ها را به صورت بلور رشد داد که این موضوع باعث محبوبیت شان در نمایش های آموزشی آزمایشگاهی شده است. هر یک از مثال های زیر جنبه متفاوتی از شیمی استات و کاربردهای آن را نشان می دهد.
| نام استات | فرمول شیمیایی | روش تهیه (آزمایشگاهی) | خواص فیزیکی | کاربردها |
|---|---|---|---|---|
| سدیم استات | CH3COONa | خنثی کردن اسید استیک با NaOH یا NaHCO3 | جامد بلوری سفید (اغلب هیدراته)؛ محلول در آب | بافر در آزمایشگاه؛ مورد استفاده در پدهای گرمکن دست و طعمدهنده غذایی |
| کلسیم استات | Ca(CH3COO)2 | واکنش اسید استیک با کربنات کلسیم (مثال: پوسته تخممرغ) | جامد سفید رطوبتگیر؛ محلول در آب و الکل | افزودنی غذایی (نگهدارنده)؛ استفاده تاریخی برای تولید استون و تهیه سوخت ژل اتانول |
| آمونیوم استات | CH3COONH4 | خنثی کردن اسید استیک با محلول آمونیاک | جامد سفید رطوبتگیر؛ در آب یک بافر ضعیف تشکیل میدهد | محلول بافر برای آزمایشهای بیوشیمی؛ به کار رفته در برخی سنتزهای آلی |
| مس (II) استات | Cu(CH3COO)2 | حل کردن اکسید یا کربنات مس در اسید استیک | بلورهای آبی-سبز براق؛ حلالیت متوسط در آب | رنگدانه (زنگار)؛ کاتالیزور در واکنشهای آلی؛ نمایش رشد بلور |
| روی استات | Zn(CH3COO)2 | واکنش فلز یا اکسید روی با اسید استیک | جامد بلوری بیرنگ (دو آبه)؛ بسیار محلول در آب | مکملهای غذایی و قرصهای مکیدنی سرماخوردگی؛ معرف آزمایشگاهی |
| اتیل استات | CH3COOC2H5 | استری شدن فیشر اسید استیک + اتانول (با کاتالیزگر اسیدی) | مایع بیرنگ و فرار با بوی شیرین؛ نقطه جوش ~77°C | حلال رنگ و پوششها؛ جزو ترکیبات پاککن لاک ناخن |
| متیل استات | CH3COOCH3 | استری کردن اسید استیک با متانول (یا انیدرید استیک) | مایع بیرنگ و قابل اشتعال؛ بسیار فرار (نقطه جوش ~57°C) | حلال با تبخیر سریع برای رنگها و چسبهایی که به سرعت خشک میشوند |
| ایزوآمیل استات | CH3COOC5H11 | استری شدن فیشر اسید استیک + ایزوآمیل الکل | مایع بیرنگ با بوی قوی شبیه موز؛ نامحلول در آب | طعمدهنده (روغن موز)؛ ماده معطر؛ مورد استفاده برای آزمایش عملکرد ماسک تنفسی |
استات سلولز و استات های پلیمری
گروههای استات را میتوان به پلیمرها متصل کرد و موادی مانند استات سلولز تولید نمود. این ماده از استیله کردن سلولز (از پنبه یا خمیر چوب) با انیدرید استیک در حضور کاتالیزگر اسیدی حاصل می شود. در آزمایش نمایشی پنبه یا کاغذ را در انیدرید استیک و مقدار کمی اسید سولفوریک خیس می کنند تا گروه های استات به زنجیره های سلولز افزوده شوند و محصولی پلاستیک مانند به دست آید که قابل قالب گیری یا ریسیدن به الیاف است. تاریخی ترین کاربرد آن ساخت فیلم عکاسی ایمن تر نسبت به فیلم نیترات سلولز بود. استات های پلیمری متنوع اند ؛ پلی وینیل استات (PVAc) از پلیمریزاسیون وینیل استات به دست می آید و پایه بسیاری از چسب ها و رنگ های لاتکس است. استات نشاسته نیز با وارد کردن گروه های استات به مولکول های نشاسته ویژگی هایی مانند مقاومت آبی بیشتر پیدا می کند. این پلیمرها معمولاً صنعتی تولید می شوند ، اما در مقیاس آزمایشگاهی هم قابل تهیه اند. این گستره نشان می دهد شیمی استات از ترکیبات ساده تا پلیمرهای با وزن مولکولی بالا را دربرمی گیرد.
مسیرهای زیستی تولید استات ها
تولید زیستی استات مسیر مهم دیگری است که حتی می توان آن را در محیط آزمایشگاه از طریق تخمیر دنبال کرد. برخی باکتری ها (به ویژه گونه های استوباکتر) قادرند اتانول (الکل) را در حضور اکسیژن به اسید استیک اکسید کنند ؛ این فرآیند در تولید سرکه به کار می رود. در آزمایشگاه می توان یک مولد سرکه ساده راه اندازی کرد ؛ به این صورت که یک ماده الکلی (مانند شراب یا سیب) در معرض هوا قرار گرفته و باکتری های تولیدکننده سرکه به آن اضافه شوند. با گذشت زمان ، باکتری ها الکل را به اسید استیک تبدیل می کنند و در نتیجه یک محلول رقیق استات (سرکه) به دست می آید. تولید زیستی این اسید نسبت به روش های شیمیایی کندتر است اما دوستدار محیط زیست بوده و از منابع تجدیدپذیر استفاده می کند. در پژوهش های بیوتکنولوژی تخمیر میکروبی برای تولید نه تنها اسید استیک بلکه استفاده از استات به عنوان بلوک سازنده سایر مواد شیمیایی نیز مطالعه می شود. توانایی میکروب ها در تولید استات از قندها یا زیست توده های زائد نمونه ای از یک رویکرد پایدار در تولید استات است که مکمل سنتز شیمیایی متداول می باشد.
خالص سازی و جداسازی محصولات استات
پس از سنتز یک ترکیب استات ، خالص سازی برای به دست آوردن محصول قابل استفاده ضروری است و روش آن به نوع استات بستگی دارد. در مورد نمک های استات جامد جداسازی معمولاً با تبلور انجام می شود. پس از واکنش خنثی سازی ، محلول تغلیظ و سپس سرد می شود تا بلورهای استات رسوب کنند. این بلورها با فیلتراسیون جمع آوری با آب یا الکل سرد شسته و سپس خشک می شوند. برای افزایش خلوص می توان دوباره کریستالیزه کرد (حل کردن در آب داغ و سرد کردن مجدد). در مورد استرهای استات مایع ، خالص سازی شامل استخراج و تقطیر است. پس از واکنش استریفیکاسیون ، مخلوط حاوی آب ، اسید و الکل واکنش نداده است. با استفاده از قیف جداکننده ، استر کم چگال از آب جدا می شود. لایه آلی با محلول بی کربنات سدیم (برای خنثی سازی اسید) و آب نمک (برای کاهش آب باقی مانده) شسته می شود. سپس ماده خشک کننده ای مانند سولفات منیزیم بی آب اضافه می شود. در نهایت با تقطیر ساده یا جزء به جزء ، استر در نقطه جوش ویژه خود جدا و خالص می گردد. این مراحل محصولی آماده برای شناسایی یا استفاده فراهم می آورد.




